Neue Erkenntnis in der Parkinson Forschung: Lipide beeinflussen Aufbau von Protein Verklumpungen
Nach Alzheimer ist #Parkinson die weltweit häufigste neurodegenerative Erkrankung. Bis zu 400.000 Betroffene leiden allein in Deutschland daran. Dabei lagern sich fehlerhafte #Alpha #Synuklein #Proteine zu faserartigen Strängen zusammen. Wenn diese sogenannten Fibrillen verklumpen, schädigen sie vermutlich Nervenzellen. Forschende haben nun gezeigt, wie Lipide an der Fibrillen Oberfläche binden und die Anordnung der Synuklein Proteine innerhalb der Fibrillen beeinflussen. Sie wiesen zudem nach, wie der Wirkstoffkandidat »anle138b« in eine Röhre im Innern einer solchen lipidischen Fibrille bindet. Die Erkenntnisse könnten neue Ansätze eröffnen, um Parkinson zu diagnostizieren und zu behandeln.
Es ist eine Krankheit mit vielen Gesichtern: Im fortschreitenden Stadium der Parkinson Erkrankung beginnen Gliedmaßen zu zittern, Muskeln werden steif, die #Bewegungen verlangsamen sich. Auch kognitive Störungen oder #Depressionen können auftreten. Derzeit gibt es weder Heilung für Parkinson noch für die verwandten #Krankheiten Lewy Körper Demenz und Multisystematrophie, bei denen ebenfalls Alpha Synuklein Fibrillen auftreten.
Auffällige Ablagerungen im #Gehirn
Ein auffallendes Merkmal der Parkinson Krankheit sind Verklumpungen der Alpha Synuklein Proteine im Gehirn. Wie andere Proteine bestehen auch diese aus langen Aminosäureketten, die sich dreidimensional korrekt falten müssen, um ihre Aufgaben zu erfüllen. In der falschen Form können sich Alpha Synuklein Proteine zu fadenförmigen Strängen, den Fibrillen, »aufeinanderstapeln«. Aus den Fibrillen wiederum können noch größere Ablagerungen entstehen. #Wissenschaftler vermuten, dass Zusammenlagerungen aus fehlgefalteten Alpha Synuklein Proteinen Nervenzellen in ihrer Funktion beeinträchtigen und zu ihrem Absterben beitragen.
In seiner korrekten Faltung ist Alpha Synuklein für die Nervenzelle allerdings unverzichtbar. Es bindet an Lipidmembranen und ist in Nervenzellen daran beteiligt, Botenstoffbehälter zu transportieren und darin enthaltene Botenstoffe freizusetzen. »Lipide scheinen aber auch mit fehlgefalteten Alpha Synukleinen zu wechselwirken«, berichtet Gunnar Schröder, Gruppenleiter am Forschungszentrum Jülich und Professor an der Heinrich Heine #Universität Düsseldorf. »Dass Wechselwirkungen zwischen Lipiden und fehlgefalteten Alpha Synuklein Proteinen eine Rolle bei der Entwicklung der Parkinson #Krankheit spielen könnten, wird bereits seit Langem vermutet. Doch bisher wissen wir nur wenig darüber«, ergänzt Bert de Groot, Forschungsgruppenleiter am Max Planck Institut (MPI) für Multidisziplinäre Naturwissenschaften.
Lipide beeinflussen Fibrillen Bildung
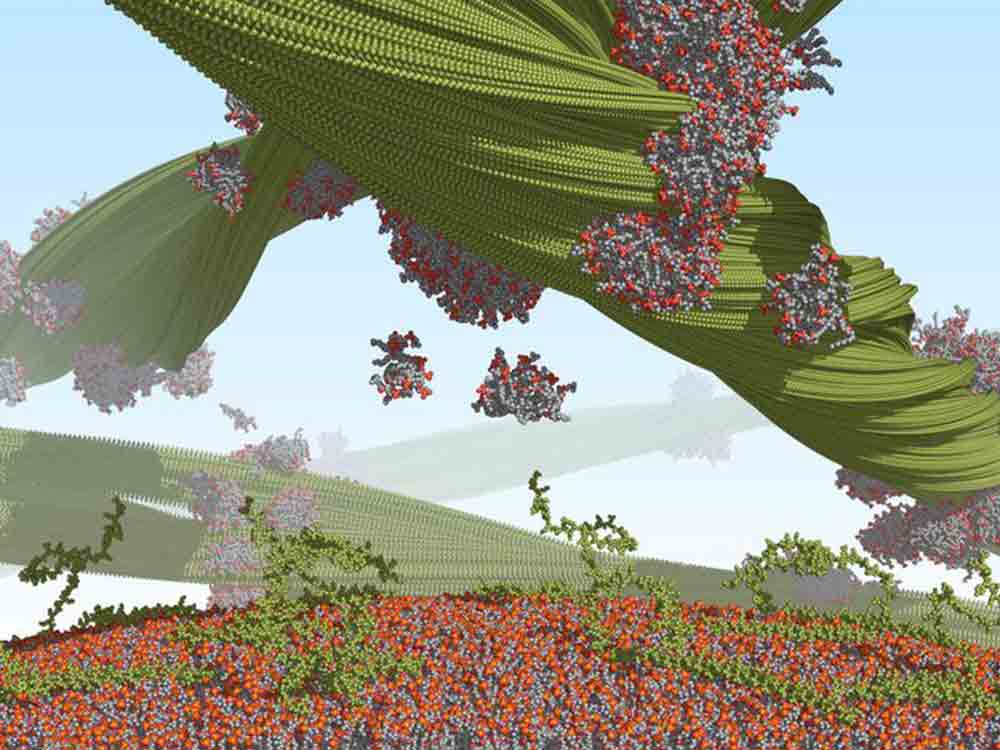
Diese Wissenslücke konnten die Wissenschaftler jetzt schließen. Ihnen gelang es, erstmals mithilfe der #Kryo #Elektronenmikroskopie sichtbar zu machen, wie sich Lipidmoleküle an die Fibrillen Oberfläche anheften und die Einheiten miteinander verbinden. Durch Einsatz aufwändiger Computersimulationen, kombiniert mit Festkörper Kernspinresonanz-Spektroskopie, konnten die Teams zudem sichtbar machen, wie die Lipid Proteinfibrillen miteinander wechselwirken.
Überraschend für die Forscherteams bildeten sich mehrere, vollkommen neuartige Fibrillen in Anwesenheit von Lipiden. »Unsere Erkenntnisse unterstreichen, dass wir Alpha Synuklein Fibrillen auch in Gegenwart von Lipiden untersuchen müssen, wenn wir die molekularen Grundlagen von Alpha Synuklein bezogenen Krankheiten verstehen wollen«, berichtet Max Planck Direktor Christian Griesinger.
Parkinson Wirkstoffkandidat »anle138b« bindet an Lipid Fibrillen
»Auch der vielversprechende Wirkstoffkandidat anle138b bindet an die Lipid Alpha Synuklein Strukturen. Der Wirkstoff setzt sich in den röhrenförmigen Hohlräumen innerhalb der lipidischen Fibrille fest«, erklärt Loren Andreas, Forschungsgruppenleiter am MPI. »Solche Hohlräume finden wir auch bei anderen Proteinen, die sich fehlfalten und mit neurodegenerativen Erkrankungen in Zusammenhang gebracht werden, zum Beispiel dem #Tau und dem Prion #Protein. Die spannende Frage für uns ist nun, ob ›anle138b‹ sich dort ähnlich anlagert und somit auch für solche Erkrankungen einen #Diagnose und #Therapieansatz liefern könnte.«
»Anle138b« wurde 2013 von Griesingers Team zusammen mit #Kollegen um Armin Giese von der Ludwig Maximilians #Universität München entwickelt. In Tests an #Mäusen verzögert der Wirkstoff erfolgreich das Fortschreiten der #Parkinson Erkrankung. Zurzeit wird er von der Modag AG in einer Zusammenarbeit mit der Firma Teva weiterentwickelt. In einer klinischen Phase I Studie erwies er sich als für den Menschen verträglich, was die weiteren laufenden klinischen Prüfungen ermöglicht.







































 Gütsel RSS Feed
Gütsel RSS Feed